| Thema: Saure und alkalische Haushaltssubstanzen III | Tags: Indikator, Rotkohl, Säure, Base | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
Reagenzglasständer, Reagenzgläser, Messer, Schneidebrett, Heizplatte, 500 ml Becherglas, Trichter, Filterpapier,
Chemikalien
Wasser, Rotkohl, Salzsäure (0,1 m), Natronlauge (0,1 m), Haushaltsessig, Natron, Kernseife, Alkohol, Rohrreiniger
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Salzsäure 0,1 M | H290 | -- |  |
| Natronlauge 0,1 M | H314 | P280-P305+P351+P338-P310 |  |
| Essigsäure | H314 | P280-P301+P330+P331-P305+P351+P338-P309+P310 |  |
| Natriumhydrogencarbonat | -- | -- | |
| Ethanol | 225‐319 | 210‐240‐305+351+338‐403+233 |   |
Durchführung
Der Rotkohl wird in kleinere Blätter geschnitten und anschließend in ein 500 ml Becherglas gegeben. Dieses wird mit 200 mL Wasser aufgefüllt und kurz aufgekocht. Anschließend wird die gekochte Rotkohl-Lösung filtriert. Nachdem die Lösung abgekühlt ist, werden jeweils 1 mL in Reagenzgläser gefüllt und mit 1 mL Wasser verdünnt. (Die Lösung sollte nicht zu stark konzentriert sein, sodass durch die Lösung hindurchgeschaut werden kann.) Anschließend können diverse Haushaltssubstanzen in die Reagenzgläser gefüllt werden und die Farben der Lösung beobachtet werden. Mit einem pH-Meter werden anschließend die pH-Werte der einzelnen Lösungen ermittelt.
Beobachtung
Der Rotkohlsaft in den einzelnen Reagenzgläsern verfärbt sich. Die Farben mit den dazugehörigen Substanzen und pH-Werten sind in nachstehender Tabelle aufgelistet.
Tabelle 1: Farbumschläge nach Zugabe der Haushaltssubstanzen.
| Substanz | Farbe | pH-Wert |
|---|---|---|
| Salzsäure | rot | 1,61 |
| Haushaltsessig | Hellrot | 3,03 |
| Kernseife in Alkohol | Violett | 5,92 |
| Kernseife in Wasser | Violett | 6,32 |
| Natron | Blau | 8,06 |
| Natronlauge | Grün | 11,09 |
| Rohrreiniger | Gelb | 11,60 |

Deutung
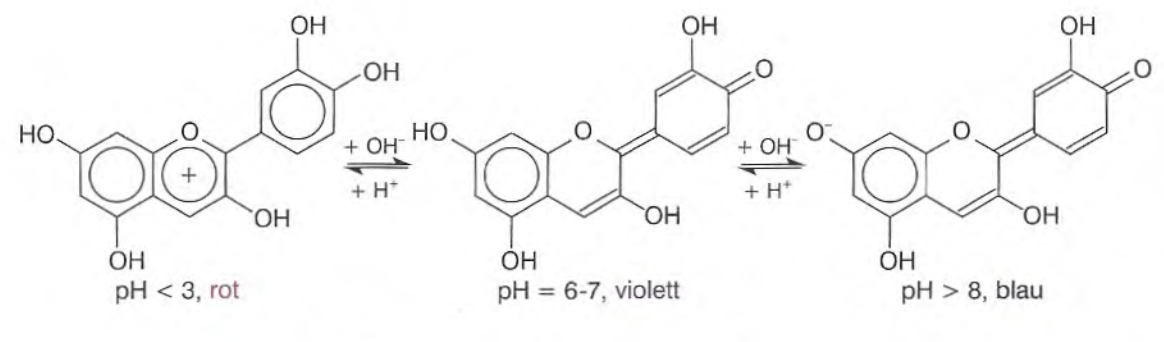
Die einzelnen Farben der Lösungen gehen vom Farbstoff des Rotkohlsaftes aus. Bei dem Farbstoff handelt es sich um Cyanidin, welcher zur Klasse der Anthocyane gehört. Die Farbe ergibt sich aus der Anregung von Elektronen des π-Elektronensystems der Verbindung und deren zurückfallen auf ihr ursprüngliches Energieniveau. Beim Zurückfallen emittieren sie Licht, welches der Energie ihrer Anregung entsprach. Durch die Protonierung bzw. Deprotonierung vergrößert bzw. verkleinert sich das π-Elektronensystem. Somit werden die Elektronen auf andere Energieniveaus angehoben und durch das zurückfallen werden andere Farben emittiert.
In Abbildung 2 ist die Verbindung des Cyanidins abgebildet.
Da das Thema der π-Elektronen erst in der Oberstufe behandelt wird, kann hier didaktisch Reduziert werden. Somit sollen die SuS den Rotkohlsaft als Universalindikator beschreiben, welcher bei unterschiedlichen pH-Werten unterschiedliche Farben anzeigt.
Entsorgung
Die Lösungen werden im Abfallbehälter für Säure-Base entsorgt.
Literatur
Der Versuch eignet sich um den SuS die Funktionsweise eines Indikators näherzubringen. Des Weiteren eignet sich der Versuch als Einstieg in das Thema der Säure-Base-Chemie, da die SuS verschiedene Haushaltsgegenstände untersuchen und diese anschließend beispielsweise nach sauer, alkalisch und neutral einzuordnen.
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.