| Thema: Reinstoffe und Stoffgemische | Tags: Reinstoff, Stoffgemisch, Trennung | Klassenstufen: 5-6 | Versuchsart: SV |
Materialien
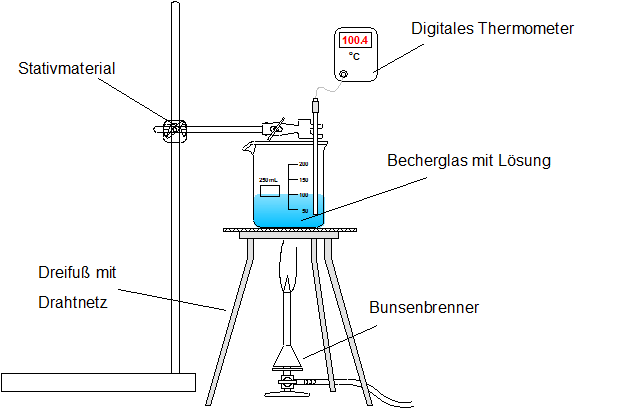
2 x Bechergläser (250ml), Dreifuß + Drahtnetz, Gasbrenner, Glasstab, Stativmaterial, Stoppuhr, Thermometer (digital), Tiegelzange
Chemikalien
Wasser, Kochsalz
Durchführung
Zunächst wird eine gesättigte Salzlösung hergestellt. Nacheinander werden jeweils 100ml einer reinen Wasserlösung (destilliert) und einer gesättigten Kochsalzlösung erhitzt. Über einen Zeitraum von ca. 16 Minuten wird in regelmäßigen Abständen, z.B. im 2-Minutenabstand, die Temperatur abgelesen und notiert. Zwischendurch sollte die jeweilige Lösung mit einem Glasstab gerührt werden. Nach der Versuchsreihe wird das Becherglas vorsichtig mit der Tiegelzange von dem Dreifuß genommen (Achtung heiß!).
Beobachtung
Teil 1: Das reine Wasser beginnt nach kurzer Zeit zu sieden und verdampft. Nach Beendung der Messreihe des destillierten Wassers sind keine Rückstände in dem Becherglas zu sehen. Die Temperatur steigt nicht höher, als 96,5°C.
Teil 2: Die Salzlösung beginnt nach kurzer Zeit zu sieden, es entsteht Dampf. Nach Beendung der Messreihe des der Salzlösung bleibt ein weißer Feststoff an den Wänden des Becherglases zurück. Die Temperatur erreicht bis zu 108,8°C.
Deutung
Durch das gelöste Salz ändert sich die charakteristische Eigenschaft des Wassers, wodurch die Salzlösung eine höhere Temperatur erreichen kann, als die reine Wasserlösung. Durch das Verdampfen des Wassers sinkt die Menge des Wassers in dem Becherglas. Die Menge des Salzes ändert sich jedoch nur gering (ein Teil setzt sich an den Wänden des Becherglases ab), wodurch die Temperatur weiter steigen kann, da Salz, wie wir aus V4 wissen einen Siedepunkt von ca. 900°C besitzt. Da die Temperatur von der Menge des gelösten Salzes abhängt, kann man keinen präzisen Siedepunkt für eine Salzlösung angeben, man spricht stattdessen von einem Siedebereich.
Entsorgung
Die Lösungen können über den Abfluss entsorgt werden.
Literatur
In Anlehnung an: H-P. Willig, http://www.chemie-schule.de/chemieAnorganische/anKap1-03-experimente-zur-stoffbeschreibung.php, unbekannt (Zuletzt abgerufen am 29.09.2012 um 07:58)
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.