| Thema: Aggregatzustände | Tags: Schmelzpunkt, Stoffeigenschaft, Aggregatzustand | Klassenstufen: 5-6 | Versuchsart: SV |
Materialien
Digitales Schülerthermometer, 100 ml Becherglas, Heizplatte mit Magnetrührer, Stativ, kurzes Reagenzglas. Draht-Mischer (siehe Durchführung)
Chemikalien
Wasser, Stearinsäure
Durchführung
Wasser wird im Becherglas unter Rühren auf einem Heizrührer gekocht. Das Reagenzglas wird etwa 3 cm hoch mit Stearinsäure befüllt und mit einer Stativklemme am Stativ befestigt. Zur Herstellung des Drahtmischers wird z.B. Eisendraht (Durchmesser: 1 mm) in eine Spirale von 1.5 cm Länge um einen Bleistift aufgewickelt und dann ca. 10 cm über der Spirale abgeschnitten. Der Temperaturfühler des Thermometers wird durch die Spirale des Draht-Mischers geführt und beide zusammen im Reagenzglas in die Stearinsäure gesteckt. Das am Stativ befestigte Reagenzglas mit Stearinsäure wird im Wasserbad erhitzt. Mit Hilfe des Draht-Mischers wird die Stearinsäure ab und zu durchmischt bis diese flüssig ist und eine Temperatur von 90 °C angezeigt wird. Danach wird das Reagenzglas mit der Stativklemme am Stativ nach oben geschoben, so dass es frei in der Luft hängt. Ab diesem Zeitpunkt wird die Stearinsäure ständig mit Hilfe des Drahtmischers durchmischt und in Abständen von 30 Sekunden wird die Temperatur der Stearinsäure in eine Tabelle eingetragen.
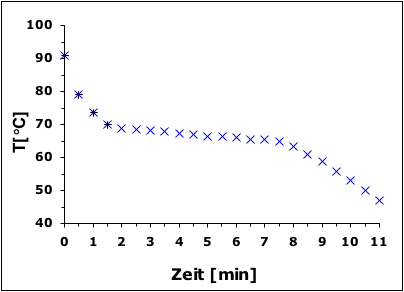
Beobachtung
Die Stearinsäure kühlt sich innerhalb von 2.5 Minuten bis auf 68.5 °C. Ab diesem Zeitpunkt wird die Stearinsäure allmählich fester und die Temperatur sinkt innerhalb von 6 Minuten lediglich auf 65.5 °C ab. Nach dem Erstarren sinkt die Temperatur in 3 Minuten bis auf 47 °C.
Deutung
Durch Erhitzen wird die Stearinsäure geschmolzen. Die Temperatur fällt zunächst stark ab, beim Erstarren der Stearinsäure bleibt die Temperatur aber konstant. Wärmeenergie ist in der Bewegung von Teilchen enthalten. Die Anteile der Stearinsäure die erstarren geben Ihre Wärme an die Umgebung ab, so dass die Temperatur während des Erstarrens konstant bleibt. Achtung: Diese Erklärung ist eine Reduktion, aber die fachliche korrekte Erklärung würde die Einführung des Teilchenmodells und der Gitterenergie bedürfen.
Literatur
Fischer, W., Glöckner W. (Hrsg.) 1988. Stoff und Formel (Ausgabe NRW) Bamberg: C.C. Bu
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.